|
01.01.15
Конкурс РФФИ 2015 года
Российский фонд фундаментальных исследований (РФФИ) проводит конкурс проектов участия российских ученых в научных мероприятиях, проводимых за рубежом 2012 года. Заявки принимаются до 01.11.2015 Внимание Вышла в продажу вторая редакция книги "Twenty-First Century. General Chemistry" |
Home / Публикации / Статьи / ТЕОРИЯ ХИМИЧЕСКИХ РЕАКЦИЙ ТЕОРИЯ ХИМИЧЕСКИХ РЕАКЦИЙВ ходе развития теории химических реакций возникли следующие основные вопросы:
Примерами таких реакций могут служить взаимодействие радикалов и ионов с молекулами, каталитические и фотохимические реакции. Данный вопрос не был затронут вплоть до начала наших работ. Цепной механизм химической реакции
AB + CD → AC + BD, а, в основном, механизм химической реакции - цепной: AB ⇄ A + B A + CD → AC + D D + AB → DB + A где A, B и D - активные частицы (радикалы, ионы, координационно-ненасыщенные соединения). То есть, в отличие от идеологии, принятой в XX веке, активные элементы (частицы, вызывающие химические преобразования) в химических реакциях -это не частицы или молекулы с высокой кинетической энергией. Активные элементы - это особые химические частицы (радикалы, ионы, координационно-ненасыщенные соединения и т.д.), у которых количество электронов меньше, чем у ближайшего к ним инертного газа. Элементарные стадии химической реакцииБыло найдено, что взаимодействие этих частиц с насыщенными молекулами проходит через три элементарные стадии (ступени):
Приведенная схема механизма химических реакций позволяет дать ответ на основные поставленные выше вопросы. Активные частицы находятся в термодинамическом равновесии с исходными молекулами. Когда температура снижается, происходит резкое уменьшение концентрации активных частиц, что, в свою очередь, приводит к резкому замедлению скорости химических реакций. Эта зависимость скорости химической реакции от температуры объясняет, почему не все термодинамически возможные реакции протекают при нормальной температуре (вопрос 1) и почему скорость реакции экспоненциально зависит от температуры (вопрос 2). Наличие стадии электронной изомеризации в механизме химической реакции отвечает на четвертый вопрос. Скорость электронной изомеризации на много порядков выше скорости стадии диссоциации. Именно поэтому кинетические параметры электронной изомеризации, в первую очередь энергия активации, не влияют на энергию активации реакции в целом. Т аким образом, энергия, необходимая для разрыва связей в исходной молекуле, равна энергии активации самой медленной стадии (диссоциации) в реакциях взаимодействия активных частиц с насыщенной молекулой. В результате электронной изомеризации исходная ковалентная химическая связь, для разрушения которой необходима энергия около 400 кДж/моль, трансформируется в ван-дер-ваальсовую связь (ВВС), для разрыва которой необходимо затратить менее 20 кДж/моль. Теперь становится понятным, почему для разрыва связи в присутствии активных частиц требуется несравненно меньшее количество энергии, чем на термическое разрушение связи в исходных молекулах (вопрос 3). Согласно механизму химической реакции скорость реакции определяется концентрацией промежуточного соединения и активных частиц. Катализатор - это химическое вещество, которое образует бОльшее количество активных частиц в системе, чем исходные молекулы при той же температуре. Роль катализатора в химической реакции >> |

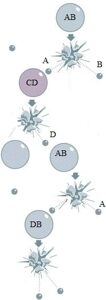 В наших исследованиях мы выяснили, что, в отличие от мнения, господствовавшего до конца XX века, взаимодействие молекул протекает не по схеме:
В наших исследованиях мы выяснили, что, в отличие от мнения, господствовавшего до конца XX века, взаимодействие молекул протекает не по схеме: Обычно стадия диссоциации ограничивает скорость процесса.
Обычно стадия диссоциации ограничивает скорость процесса.